
Czy za jedną strzałkę w równaniu reakcji można stracić punkty?
Pytanie o to, czy to prawda, że za jedną strzałkę nie traci się punktu na maturze pojawia się bardzo regularnie. Odpowiedzi, które są udzielane pytającym osobom przez innych maturzystów i tych, którzy maturę mają już za sobą zawsze brzmią podobnie: „pisz ZAWSZE jedną strzałkę, bo to ZAWSZE jest dobrze, a jak napiszesz strzałki w dwie strony tam, gdzie nie może być dwóch, to będzie błąd”. Wśród maturzystów w wielu kwestiach panuje psychoza, a kwestia dwóch strzałek nie jest wyjątkiem. Potem mamy sytuacje, gdy maturzysta oblicza skład RÓWNOWAGOWY, albo STAŁĄ RÓWNOWAGI, a jednocześnie boi się napisać równanie reakcji z dwoma strzałkami. Rzeczywiście, maturzysta nie utraci punktu, jeśli równanie reakcji odwracalnej zapisze z jedną strzałką. A co, jeśli udowodnię, że za brak dwóch strzałek także można utracić punkty? Bo jedna rzecz bardzo często umyka nie tylko maturzystom, a diabeł tkwi w szczegółach.
Nazywam się Damian Mickiewicz i jestem doktorantem w Polskiej Akademii Nauk, a chemia i przekazywanie wiedzy chemicznej to moja pasja. Prowadzę portal Biomist i współpracuję z OKE Łódź. Od 17 lat pomagam maturzystom na forach internetowych i grupach dyskusyjnych, a także prowadzę lekcje online w ramach Powtórki z chemii. Jestem autorem dwóch podręczników poświęconych obliczeniom chemicznym. Walka o poprawę nauczania chemii jest moim celem, więc pokazuję chemię tak, jak uważam że powinno się jej uczyć, by przynieść dobre efekty.
W ogólnych zasadach oceniania znajdujemy uwagę:
„W równaniach reakcji, w których ustala się stan równowagi, brak „⇄” nie powoduje utraty punktów”
Ale zwróćmy uwagę, że chodzi tutaj wyłącznie o zapis równania reakcji. Zapis ze strzałką w jedną stronę (czyli na ogół w prawo „→”) zwykle oznacza, że rozpatrywana reakcja jest nieodwracalna, czyli zachodzi praktycznie z lewa na prawo (α≈100%), a w takim przypadku nie działa na nią reguła przekory. Z kolei zapis ze strzałkami równowagi (czyli „⇄”) oznacza reakcję odwracalną, czyli równowagową, na której stopień przereagowania można wpływać – działa tutaj reguła przekory. Do tego zresztą nawiązują strzałki w obu kierunkach, bo można przekształcać substraty w produkty, a produkty przekształcić z powrotem w substraty itd.
A teraz zajmijmy się zadaniami maturalnymi. Latem 2020 roku napisała do mnie pewna osoba z powodu „błędu w kluczu” mówiąc wprost, przez co pewna osoba niesłusznie utraciła punkty. Konkretnie chodziło o zadanie 15 z arkusza z lipca 2020. Poniżej widzimy odpowiedź do tego zadania ze schematu oceniania.
Wspomniana osoba zapisała nawet na boku równanie reakcji, na podstawie którego wybrała odpowiedź: P czy F:
I zaznaczyła F. Nasza dyskusja dotyczyła tego, że wg zasad oceniania („klucza”) jest P, a powinno być F, ponadto odpowiedź P w kluczu jest sprzeczna z odpowiedzią F w zdaniu drugim.
Nasza konwersacja skupiła się na tym, czy w wodnym roztworze Na2CO3 rzeczywiście nie ma jonów CO32-, które są wyłącznie zasadami w takich układach. Czy w zasadach oceniania faktycznie był błąd? Nie. Po prostu zdająca wyciągnęła zły wniosek na podstawie tak zapisanego równania reakcji: z jedną strzałką. Nasza konwersacja skupiła się na tym, czy tam są jony CO32-, czy nie, ale zwróćmy uwagę na jeszcze coś. Nawet gdyby hydroliza zachodziła w 100% (co sugeruje zapis „z jedną strzałką”) i jonów CO32- rzeczywiście w tym roztworze by nie było, to przecież są także jony OH– – one zawsze są w roztworach wodnych. I są wyłącznie zasadami w takich roztworach. Więc czy hydroliza zachodzi odwracalnie, czy nie (czy w roztworze Na2CO3 są lub nie ma jonów CO32-), to aniony mogące pełnić rolę wyłącznie zasady i tak są w tym roztworze. I już choćby to świadczy o tym, że odpowiedź P jest prawidłowa. Ale wróćmy do tematu obecności anionów węglanowych. Gdy równanie reakcji jest elementem ocenianym, to za jego zapisanie z jedną strzałką, nawet gdy mowa o reakcji równowagowej – punktu nie stracimy. Pod warunkiem, że równanie zapisane jest dobrze. Ale zapisanie czegoś z jedną strzałką na papierze nie oznacza, że reakcja w probówce też zachodzi „z jedną strzałką”, czyli z lewa na prawo w 100%. Albo że zacznie tak zachodzić, bo tak zapisaliśmy na papierze. Taki zapis nie zwalnia nas w żadnym przypadku ze znajomości natury procesu. Jeśli więc na podstawie tak zapisanego równania hydrolizy:
stwierdzamy, że w roztworze Na2CO3 nie ma jonów węglanowych, to popełniamy oczywisty błąd. Bo roztwór Na2CO3 to nadal roztwór Na2CO3, a nie NaHCO3 i NaOH, pomimo zachodzącej hydrolizy. Stopień hydrolizy anionu węglanowego w roztworze o stężeniu 0,51 mol/dm3 wynosi niespełna 2% (w 25 °C). Oznacza to, że ponad 98% anionów węglanowych pozostaje w roztworze. A te niespełna 2% to już dużo jak bardzo dużo jak na hydrolizę soli – możemy sprawdzić, że w roztworze octanu sodu o stężeniu 0,1 mol/dm3 hydrolizie ulega 1 na blisko 13,5 tysiąca anionów octanowych! Dodam, że przytoczony przypadek nie jest ani pierwszym, ani ostatnim tego typu, z jakim miałem do czynienia, gdy ktoś błędnie myśli o hydrolizie soli w taki właśnie sposób: że jakiegoś jonu nie ma, no bo zaszła hydroliza.
Częste problemy maturzystów, z utratą punktów włącznie, wynikają ze złego nawyku nadużywania jednej strzałki. Z dwóch powodów:
– obaw przed stosowaniem dwóch strzałek, by „nie stracić punktów”,
– niekonsekwencji w materiale szkolnym – wiele pojęć się omawianych w chaotycznej kolejności, np. hydroliza soli przed wprowadzeniem pojęcia równowagi (i dwóch strzałek) Stąd hydroliza w roztworach soli to jedno z najgorzej uczonych pojęć w szkolnej edukacji chemicznej.
Oczywiście stosujmy dla własnego komfortu jedną strzałkę, jeśli tak sami preferujemy. Ale nie popadajmy przy tym w jakąś paranoję. I nie zapominajmy, że jedna strzałka na papierze nie zmienia w magiczny sposób tego, co dzieje się w probówce – i musimy to uwzględnić w swojej odpowiedzi. Bo choć nikt nam nie zabierze punktu za równanie reakcji z jedną strzałką, to o tym, że dana reakcja jest równowagowa – już musimy wiedzieć i uwzględnić w odpowiedzi to, co z tej odwracalności wynika. Czy można utracić punkty za jedną strzałkę? Można, jeśli jej używać niewłaściwie (nadużywać) i na tej podstawie wyciągać błędne wnioski nie tylko podczas samej matury, ale takze na etapie nauki do niej…
Pozdrawiam,
Damian Mickiewicz
Jeśli zależy Ci na bardzo dobrym wyniku na maturze, to zachęcam do skorzystania z serii lekcji Zadania maturalne bez tajemnic. Podczas tych lekcji omawiam zagadnienia wymagane na maturze i pokazuję jak rozwiązywać zadania, by nie popełnić błędów. Dodatkowo otrzymasz prezentacje, zadania maturalne, a nawet moje książki w formie PDF. Szczegóły TUTAJ
Zobacz inne artykuły z tego numeru





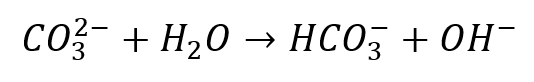


Brak komentarzy